EMTに関与する
2種類のRhoファミリー 低分子G-タンパク質:
<RhoC,Rac1b>
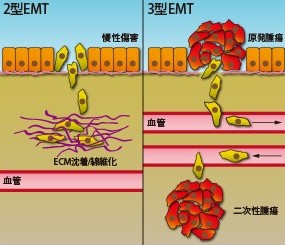
図1. 病理的EMTの2形態。慢性傷害(例:炎症)に対する2型EMT応答により、組織線維化の原因となる細胞外マトリクスの過度な沈着が生じる。3型EMTにより腫瘍細胞が転移性となり、遠位に二次性腫瘍を形成する。
RhoCは、アミノ酸配列で85%の相同性を有する3種のRho GTPaseアイソフォーム(RhoA, RhoB, RhoC)のうちの1種です6。各腫瘍におけるRhoCレベルを評価した研究では、RhoC発現の増加と患者の予後不良の間に相関があることが示され4,7-10、3型EMTにおけるRhoCの役割が示唆されました。
結腸癌細胞がEMTを経ると、活性型RhoCレベルが上昇し、活性型RhoAレベルが低下することは注目すべき現象です4。
さらに、この様なRhoアイソフォームの相反的な制御は、
EMT後の細胞における効率的な遊走に必須で、
RhoC発現と活性の上昇は内皮マーカーであるE-カドヘリン
の局在化不良や発現の消失と反比例します4。
3型EMTにおけるRhoC機能の補助として、
前EMT/前転移性マイクロRNA-10b(miR-10b)の発現
が間接的にRhoC発現を誘導することが見出された一方11、
EMTの発現によるmiR-138の抑制がRhoCと
その下流エフェクターであるROCK2の発現を低下させます12。
Rac1bは、
グアニンヌクレオチド結合に関与するスイッチII領域と
隣接した部位に19アミノ酸残基が挿入した、
Rac1の選択的スプライスバリアントであり、
アミノ酸残基が挿入されることでこのアイソフォームは
構成的に活性化され、下流エフェクタータンパク質の部分集合体へと
組み込まれます13,14。
Rac1bレベルの上昇は大腸腫瘍サンプルや15、
アルツハイマー病患者由来サンプルで観察されます16。
これは3型EMT、場合によっては2型EMTにおける
Rac1bの役割を示唆しています。
細胞培養実験では、
マトリクスメタロプロテイナーゼ-3(MMP-3)がRac1b発現の誘導と、
EMTの随伴的な誘導能を有します5。
これは、EMT過程におけるRac1bの直接的な役割を示唆しています。
さらに、MMP-3誘導性EMTに必須の段階である、
Rac1bはミトコンドリアからの活性酸素種(ROS)の
産生と放出を刺激することで、前EMT転写因子である
Snail1発現の誘導を引き起こします5。
RhoCとRac1bは、
病理的なEMTの過程において多様な役割を有する、
非常に重要なRhoファミリー低分子量G-タンパク質です。
今後の研究により、組織線維化を引き起こす2型EMTにおける
これら低分子量G-タンパク質のさらなる機能が解明されるかどうかを
確認することは、興味深いことであるといえます。
参考文献
1. Kalluri, R. and Weinberg, R.A. (2009) The basics of epithelial-mesenchymal transition. J Clin Invest. 119: 1420-1428.
2. Thiery, J.P., Acloque, H., Huang, R.Y.J. and Nieto, M.A. (2009) Epithelial-mesenchymal transitions in development and disease. Cell. 139: 871-890.
3. Lee, J.M., Dedhar, S., Kalluri, R. and Thompson, E.W. (2006) The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 172: 973-981.
4. Bellovin D.I., Simpson, K.J., Danilov, T., Maynard, E., Rimm, D.L., Oettgen, P. and Mercurio, A.M. (2006) Reciprocal regulation of RhoA and RhoC characterize the EMT and identifies RhoC as a prognostic marker for colon cancer. Oncogene. 25: 6959-6967.
5. Radisky, D.C., Levy, D.D., Littlepage, L.E., Liu, H., Nelson, C.M., Fata, J.E., Leake, D., Godden, E.L., Albertson, D.G., Nieto, M.A., Werb, Z. and Bissell, M.J. (2005) Rac1b and reactive oxygen species mediate MMP-3-induced EMT and genomic instability. Nature. 436: 123-127.
6. Wheeler, A.P. and Ridley, A.J. (2004) Why three Rho proteins? RhoA, RhoB, RhoC, and cell motility. Exp Cell Res. 301: 43-49.
7. van Golen, K.L. Wu, Z.F., Qiao, X.T., Bao, L.W. and Merajver, S.D. (1999) A novel putative low-affinity insulin-like growth factor-binding protein, LIBC (Lost in Inflammatory Breast Cancer), and RhoC GTPase correlate with the inflammatory breast cancer phenotype. Clin Cancer Res. 5: 2511-2519.
8. Clark, E.A., Golub, T.R., Lander, E.S. and Hynes, R.O. (2000) Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406: 532-535.
9. Shikada, Y., Yoshino, I., Okamoto, T., Fukuyama, S., Kameyama, T. and Maehara, Y. (2003) Higher expression of RhoC is related to invasiveness in non-small cell lung carcinoma. Clin Cancer Res. 9: 5282-5286.
10. Wang, W., Yang, L.Y., Huang, G.W., Lu W.Q., Yang, Z.L., Yang, J.Q. and Liu, H.L. (2004) Genomic analysis reveals RhoC is a potential marker in hepatocellular carcinoma with poor prognosis. Br J Cancer. 90: 2349-2355.
11. Ma, L., Teruya-Feldstein, J. and Weinberg, R.A. (2007) Tumour invasion and metastasis initiated by microRNA-10b in breast cancer. Nature. 449: 682-688.
12. Jiang, L., Liu, X., Kolokythras, A., Yu, J., Wang, A., Heidreder, C.E., Shi, F. and Zhou, X. (2010) Downregulation of the Rho GTPase signaling pathway is involved in the microRNA-138-mediated inhibition of cell migration and invasion in tongue squamous cell carcinoma. Int J Cancer. 127: 505-512.
13. Matos, P., Collard, J.G. and Jordon, P. (2003) Tumor-related alternatively spliced Rac1b is not regulated by Rho-GDP dissociation inhibitors and exhibits selective downstream signaling. J Biol Chem. 278: 50442-50448.
14. Fiegen, D., Haeusler, L-C., Blumenstein, L., Herbrand, U., Dvorsky, R., Vetter, I.R. and Ahmadian, M.R. (2004) Alternative splicing of Rac1 generates Rac1b, a self-activating GTPase. J Biol Chem. 279: 4743-4749.
15. Jordon, P., Brazão, R., Boavida, M.G., Gespach, C. and Chastre, E. (1999) Cloning of a novel human Rac1b splice variant with increased expression in colorectal tumors. Oncogene. 18: 6835-6839.
16. Perez, S.E., Getova, D.P., He, B., Counts, S.E., Geula, C., Desire, L., Coutadeur, S., Peillon, H., Ginsberg, S.D. and Mufson, E.J. (2012) Rac1b increases with progressive Tau pathology within cholinergic nucleus basalis neurons in Alzheimer’s disease. Am J Path. 180: 526-540.
2. Thiery, J.P., Acloque, H., Huang, R.Y.J. and Nieto, M.A. (2009) Epithelial-mesenchymal transitions in development and disease. Cell. 139: 871-890.
3. Lee, J.M., Dedhar, S., Kalluri, R. and Thompson, E.W. (2006) The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 172: 973-981.
4. Bellovin D.I., Simpson, K.J., Danilov, T., Maynard, E., Rimm, D.L., Oettgen, P. and Mercurio, A.M. (2006) Reciprocal regulation of RhoA and RhoC characterize the EMT and identifies RhoC as a prognostic marker for colon cancer. Oncogene. 25: 6959-6967.
5. Radisky, D.C., Levy, D.D., Littlepage, L.E., Liu, H., Nelson, C.M., Fata, J.E., Leake, D., Godden, E.L., Albertson, D.G., Nieto, M.A., Werb, Z. and Bissell, M.J. (2005) Rac1b and reactive oxygen species mediate MMP-3-induced EMT and genomic instability. Nature. 436: 123-127.
6. Wheeler, A.P. and Ridley, A.J. (2004) Why three Rho proteins? RhoA, RhoB, RhoC, and cell motility. Exp Cell Res. 301: 43-49.
7. van Golen, K.L. Wu, Z.F., Qiao, X.T., Bao, L.W. and Merajver, S.D. (1999) A novel putative low-affinity insulin-like growth factor-binding protein, LIBC (Lost in Inflammatory Breast Cancer), and RhoC GTPase correlate with the inflammatory breast cancer phenotype. Clin Cancer Res. 5: 2511-2519.
8. Clark, E.A., Golub, T.R., Lander, E.S. and Hynes, R.O. (2000) Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406: 532-535.
9. Shikada, Y., Yoshino, I., Okamoto, T., Fukuyama, S., Kameyama, T. and Maehara, Y. (2003) Higher expression of RhoC is related to invasiveness in non-small cell lung carcinoma. Clin Cancer Res. 9: 5282-5286.
10. Wang, W., Yang, L.Y., Huang, G.W., Lu W.Q., Yang, Z.L., Yang, J.Q. and Liu, H.L. (2004) Genomic analysis reveals RhoC is a potential marker in hepatocellular carcinoma with poor prognosis. Br J Cancer. 90: 2349-2355.
11. Ma, L., Teruya-Feldstein, J. and Weinberg, R.A. (2007) Tumour invasion and metastasis initiated by microRNA-10b in breast cancer. Nature. 449: 682-688.
12. Jiang, L., Liu, X., Kolokythras, A., Yu, J., Wang, A., Heidreder, C.E., Shi, F. and Zhou, X. (2010) Downregulation of the Rho GTPase signaling pathway is involved in the microRNA-138-mediated inhibition of cell migration and invasion in tongue squamous cell carcinoma. Int J Cancer. 127: 505-512.
13. Matos, P., Collard, J.G. and Jordon, P. (2003) Tumor-related alternatively spliced Rac1b is not regulated by Rho-GDP dissociation inhibitors and exhibits selective downstream signaling. J Biol Chem. 278: 50442-50448.
14. Fiegen, D., Haeusler, L-C., Blumenstein, L., Herbrand, U., Dvorsky, R., Vetter, I.R. and Ahmadian, M.R. (2004) Alternative splicing of Rac1 generates Rac1b, a self-activating GTPase. J Biol Chem. 279: 4743-4749.
15. Jordon, P., Brazão, R., Boavida, M.G., Gespach, C. and Chastre, E. (1999) Cloning of a novel human Rac1b splice variant with increased expression in colorectal tumors. Oncogene. 18: 6835-6839.
16. Perez, S.E., Getova, D.P., He, B., Counts, S.E., Geula, C., Desire, L., Coutadeur, S., Peillon, H., Ginsberg, S.D. and Mufson, E.J. (2012) Rac1b increases with progressive Tau pathology within cholinergic nucleus basalis neurons in Alzheimer’s disease. Am J Path. 180: 526-540.
0 件のコメント:
コメントを投稿