 | ||||
生理活性物質としての 硫化水素Hydrogen Sulfide As a Bioactive Molecule
Hydrogen sulfide(H2S) is recognized as a neuromodulator, smooth muscle relaxant, cytoprotectant, and the regulator of insulin release. H2S is produced from L-cysteine by cystathionine β-synthase(CBS), cystathionine γ-lyase(CSE), and 3-mercaptopyruvate sulfurtransferase(3MST) coupled with cysteine aminotransferase(CAT). A part of H2S produced by enzymes is stored in cells as bound sulfane sulfur, which in turn releases H2S when cells are stimulated. The current methods such as gas-chomatography and poralography for H2S detection require the process of extracting H2S from cells and tissues. In contrast, recently developed fluorescent probes sensitive to H2S enabled a real-time monitoring of living-cells. This review will focus on the function and metabolism of H2S as well as the recent advance in the detection of H2S. キーワード : 硫化水素、システイン、CBS、CSE、3MST、結合型硫黄、硫化水素プローブ 1.はじめに近年、一酸化窒素(NO)と一酸化炭素(CO)に次ぐ第 3 番目の生理活性物質として、硫化水素(H2S)が注目されている。 H2S は、受容体・イオンチャネル・酵素・転写因子などを標的とし、神経伝達調節・平滑筋弛緩・細胞保護・インスリン分泌調節など実に多彩な作用を示す。 H2S の生産酵素としては、シスタチオニン-シンターゼ(CBS)・シスタチオニンγ-リアーゼ(CSE)・3-メルカプトピルビン酸サルファトランスフェラーゼ(3MST)が同定されている。生体による H2S の制御機構を解明することは生理学上の重要なポイントであるが、酵素によって生産された H2S がどのような挙動を示すのか、その貯蔵と放出のメカニズムも徐々に明らかとなってきた。最近では、 H2S を可視化する蛍光プローブが開発され、従来では不可能であった生細胞内の H2S をリアルタイムで検出する試みが行われるなど、 H2S をめぐる研究は著しい進展をみせている。本稿では、H2S の機能と代謝に関する基礎的知見を概説するとともに、H2S の動態解明に向けた新たなアプローチとして注目されている蛍光プローブの開発状況を紹介する。 2.生体内硫黄の存在様態硫黄は、人体を構成する主要 4 元素(水素・炭素・窒素・酸素)に次いでカルシウムやリンとともに多く含まれる。生体内の硫黄を存在様態に応じて区別すると、安定型と不安定型に類別できる。システインは、最も安定な還元状態(-2 価)の硫黄を有するアミノ酸であり、体内に取り込まれると、最も安定な酸化状態( +6 価)の硫黄をもつタウリンや硫酸などに代謝される(図 1a)。安定型硫黄は、酸やアルカリ、あるいはジチオスレイトール(DTT)などの強力な還元剤で処理しても切断されることはない。一方、過硫化物・多硫化物・ポリチオン酸・チオ硫酸などの硫黄は、不安定な還元状態( 0 価または -1 価)を維持しており、サルフェン硫黄(sulfane sulfur)1) と呼ばれている(図 1b)。このうち過硫化物と多硫化物のサルフェン硫黄は、DTT 還元によって H2S として放出される性質をもち、このようなサルフェン硫黄を特に結合型硫黄(bound sulfur)2) と呼んでいる。また生体には、酸性条件下で H2S を放出する酸不安定型硫黄が存在している(図 1b)。生体試料を pH 5.4 以下の酸性溶液で処理すると H2S が放出されるが 3)、この H2S は、電子伝達系酵素複合体の鉄硫黄クラスターに由来している。 図 1 安定型硫黄と不安定型硫黄
(a) 安定型硫黄 最も安定な還元状態(-2 価)または酸化状態(+6 価)にある硫黄は、DTT などの還元剤や液性の影響を受けない。 (b) 不安定型硫黄 過硫化物・多硫化物・ポリチオン酸・チオ硫酸は、不安定な還元状態( 0 価または -1 価)を維持したサルフェン硫黄をもつ。このうち過硫化物と多硫化物のサルフェン硫黄は、DTT 還元によって H2S として放出される性質をもち、このようなサルフェン硫黄を特に結合型硫黄と呼ぶ。電子伝達系酵素複合体の鉄硫黄クラスターは酸性条件下で不安定な硫黄原子をもつ。
なお、H2S がタンパク質システイン残基のチオールと反応した場合には結合型硫黄が生じるが、最近、この反応はスルフヒドリル化 4) と呼ばれている。 H2S によるスルフヒドリル化は、ATP 依存性カリウムチャネルや転写因子 Nf-kB などの活性を調節するメカニズムとして注目されている。 3. H2S の生産・貯蔵・放出H2S を生産する酵素としては、これまでに 3 種類が同定されている(図 2)。シスタチオニンβ-シンターゼ(cystathionine β-synthase, CBS)は、L-システインと L- ホモシステインから H2S を生産し、肝臓・腎臓・膵臓・脳などに存在している。シスタチオニンγ-リアーゼ(cystathionine γ-lyase, CSE)は、L- システインまたは L-ホモシステインを加水分解することで H2S を生産する。 CSE は、肝臓・腎臓・膵臓・血管などに多く存在しており、脳では活性は確認されているが、CSE タンパク質は検出されていない。おそらく、CSE と同様の活性をもつ酵素が脳に存在すると思われる。 3-メルカプトピルビン酸サルファトランスフェラーゼ(3-mercaptopyruvate sulfurtransferase, 3MST)は、ユビキタスな酵素であり、ジヒドロリポ酸やチオレドキシンなどの生体内ジチオールの存在下、3-メルカプトピルビン酸(3-mercaptopyruvate, 3MP)から H2S を生産する 5-6) 。なお 3MP は、L-システインとα-ケトグルタル酸からシステインアミノ基転移酵素(cysteine aminotransferase, CAT)によって供給される。酵素によって生産された H2S は細胞内ではどのような振舞いを示すのだろうか。その一端が、組織抽出液を用いた検討から明らかになってきた。脳抽出液に H2S を添加すると、H2S は徐々に吸収され、あたかも存在しないかのような挙動を示す 3) 。ところが、この抽出液に DTT を添加すると H2S が再び放出される。この現象は、H2S を添加していない抽出液でも認められることから、結合型硫黄が脳に存在することは確かである。この結果から、内在性 H2S は、酵素によって生産される以外にも、貯蔵型の結合型硫黄から刺激に応じて放出される場合があると思われる(図 2)。 では、結合型硫黄を H2S として放出する生理刺激とはどのようなものだろうか。一般に、還元性物質はアルカリ域でその還元力を発揮するが、生理的濃度のシステインとグルタチオンを細胞抽出液に添加すると、pH 8.4 であれば H2S が放出されることがわかった 3) 。問題は、このレベルまで細胞内がアルカリ環境となり得るかであるが、神経細胞が興奮するとグリア細胞の NaHCO3 トランスポーターが活性化される結果、グリア細胞内の液性が pH 8.4 まで上昇することを確認している。この結果から、神経活動に伴い H2S を放出する機構があると思われる。  図 2 内在性 H2S の生産・貯蔵・放出 図 2 内在性 H2S の生産・貯蔵・放出
L- システインから H2S を生産する酵素として、シスタチオニン β-シンターゼ(CBS)・シスタチオニン γ- リアーゼ(CSE) ・ 3-メルカプトピルビン酸硫黄転移酵素(3MST)がある。 3MST の基質 3-メルカプトピルビン酸(3MP)は、L-システインと α-ケトグルタル酸からシステインアミノ基転移酵素(CAT)によって供給される。生産された H2S は結合型硫黄として貯蔵され、生理的刺激に応じて H2S を放出する機構が存在する。
4.シグナル分子としての H2S神経伝達の調節因子H2S は、海馬における長期増強の誘導を促進する 7) 。それまで毒物としてのみ扱われてきた H2S がシグナル分子として機能することを初めて報告したことにより、 H2S に対する研究者の見方が大きく変わった。現在 H2S は、NO と CO に次ぐ第 3 番目の生理活性物質として認識されており、その生理作用や薬理作用が国内外を問わず数多く研究されている。H2S は、NO や CO と同様に神経伝達を調節するが、そのメカニズムが異なる。 NO は、シナプス後細胞で L- アルギニンから生産された後、シナプス前細胞へ拡散しグアニル酸シクラーゼを活性化する。その結果、cGMP 依存性リン酸化酵素が活性化し、タンパク質のリン酸化を介した神経伝達物質の放出へと至る。一方 H2S は、グアニル酸シクラーゼには影響せず、NMDA 受容体のグルタミン酸感受性を増大させる 7) 。NMDA 受容体のジスルフィド結合が切断されるとグルタミン酸感受性が増大することから、 H2S の還元力が活性化の一因とみられる。ただし、 H2S による感受性増強作用は、より強力な還元力をもつ DTT の効果を上回ることから、 H2S の還元力のみでは説明できない。この点については、さらなる解析が必要であるが、グリア細胞に関する下記の知見を考慮すると新たな示唆が得られると思われる。 グリア細胞の 1 つにアストロサイトがある。細胞内カルシウム濃度の上昇が近隣の細胞へ伝搬する現象はカルシウムウェーブとして知られるが、 H2S は、アストロサイトの膜電位依存性カルシウムチャネルを活性化することでカルシウムウェーブを誘起させる 8) 。カルシウムウェーブの生理的意義については未だ不明点が多いが、シナプスを取り囲んでいるアストロサイトは神経伝達を調節する上で重要な役割を担うと考えられている。このアストロサイトには CBS が存在し、一方の神経細胞には 3MST が存在している 5) 。これらのことから、シナプス前後細胞およびアストロサイトの 3 者間を H2S が制御している可能性がある。 平滑筋の弛緩因子内皮細胞由来平滑筋弛緩因子(EDRF)は、アセチルコリンなどの刺激に応じて放出される平滑筋の弛緩因子であり、血圧調節に重要な役割を果たす。EDRF が NO であると同定されて以降、NO のみでは説明のつかない現象が確認されており、現在、EDRF には NO 以外の成分も含まれると考えられている。その可能性のひとつが H2S である 9) 。 H2S は、単独でも平滑筋を弛緩させるが、NO が共存した場合には弛緩作用が相乗的に発揮される。問題は、H2S の生産酵素が内皮細胞に存在するかであるが、CAT と 3MST が内皮に共局在することを確認している 10) 。 H2S には、Akt を介して内皮型 NO 合成酵素を活性化し NO の生産量を高める作用 11) が確認されており、このはたらきが相乗効果の一因と考えられる。血圧を調節する要素としては、内皮細胞のみならず血管周囲の脂肪細胞も重要なはたらきを示すことが明らかとなりつつあるが、その脂肪細胞からも H2S が生産される様子である。大動脈血管にセロトニンを作用させると血管平滑筋が収縮するが、脂肪組織が付着した血管においては収縮が減弱する 12) 。減弱効果は、平滑筋に存在する KCNQ 型電位依存性カリウムチャネル(KCNQ チャネル)の阻害剤で抑制されることから、脂肪細胞からは KCNQ チャネルを開口させる「脂肪細胞由来平滑筋弛緩因子(ADRF)」が放出されると考えられている。 ADRF の実体は不明であるが、CSE が脂肪細胞に存在することに加えて、CSE 阻害剤が KCNQ チャネル阻害剤と同様の効果を示すことから、 H2S が ADRF の候補となっている 13) 。しかし、 H2S が ADRF そのものであるか、ADRF の調節因子であるかは不明である。 カルシウム濃度の調節因子H2S の新たな知見として、視細胞におけるカルシウムイオン濃度の調節作用が明らかとなった 14) 。網膜が物体の輪郭を認知する際には、水平細胞から光受容細胞に対するネガティブフィードバック機構が重要な役割を果たす。そのメカニズムとしては、水平細胞の液胞型プロトンポンプの 1 つである V 型 ATPase がプロトンを放出し、そのプロトンが光受容細胞の L 型カルシウムチャネルを阻害する経路が想定されている。これに対して H2S は以下のように関わると考えている。網膜に光が照射されると、光受容細胞内の cGMP 濃度が低下する。これにより cGMP 依存性イオンチャネルが閉じ、光受容細胞内のカルシウムイオン濃度は低下する。その結果、近傍の水平細胞に対するグルタミン酸の放出が抑制されるが、この状態では水平細胞のグルタミン酸受容体活性が阻害されているため、同細胞内へのカルシウムイオンの流入は抑制される。光受容細胞と水平細胞には CAT-3MST 経路が存在するが、この経路ではカルシウムイオン濃度の低下にともない H2S の生産活性が増加する。 H2S の生産量が増加すると、水平細胞の V 型 ATPase が活性化されプロトンの放出が促進される結果、光受容細胞周辺の pH が低下する。酸性条件下では光受容細胞のL型カルシウムチャネルは阻害されるため、最終的に光受容細胞内へのカルシウムの流入は抑制されることになる。5.H2S の細胞保護作用細胞には興奮毒性を有するグルタミン酸を排出しシスチンを取り込むアンチポーターが存在するが、グルタミン酸が過剰に生産されるとアンチポーターが阻害され、細胞内のシスチン濃度が低下する。その結果、細胞内のグルタチオンの合成量が低下し、酸化ストレスに対する抵抗性が損なわれる。これに対して H2S は、アンチポーターを活性化することでシスチンの取り込みを促進するとともに、グルタチオン合成の律速酵素である γ - グルタミルシステインシンターゼを活性化することでグルタチオン濃度の低下を防ぐ作用がある 15) 。H2S の細胞保護作用に関して注目すべき点は、単回投与で顕著な効果が得られることである。妊娠マウスの子宮卵巣動脈を閉塞した後、血流を再開させると、24 時間後には胎児脳内のグルタチオン濃度はコントロールの 24% まで減少し、全胎児が浸軟する。 しかし、母体に H2S ドナーの硫化水素ナトリウム(NaHS)を単回投与(0.4 μmol/kg)すると、グルタチオン濃度は 75% まで回復し、胎児の 3/4 は浸軟を免れる 16) 。培養細胞を用いた検討では、培地中に高濃度のグルタミン酸を添加すると、神経細胞は 8 時間後から死滅が始まり、16 時間後には細胞数が 10% 程度まで低下する。 しかし、あらかじめ H2S を培地に添加すると、死滅開始時間が 12 時間後へ遅れ、死滅率も大幅に低下する。 H2S は、添加してから 1 時間でほぼすべてが揮発してしまうことから、 H2S のシグナルは添加直後から発動されているものと思われる。 神経系における H2S の保護作用が明らかとなって以来、心血管系・消化器系・泌尿器系などにおける保護効果が相次いで報告されるようになった。たとえば、エネルギー消費の激しい心筋で梗塞が生じ、その後に血液が再灌流すると、活性酸素・炎症・アポトーシスなどが惹起される 17) 。これに対して、再灌流前に NaHS を投与すれば、損傷を軽減し機能を回復できる 18) 。 H2S は、心筋のグルタチオン合成系に作用するだけでなく、Nrf-2 を介した酸化ストレス応答系を活性化することで細胞を保護する。免疫系においては、NF-kB ・ TNF-α ・IL などの炎症性メディエーターの放出を抑制するとともに、白血球の内皮への接着を調節することで血管透過性の亢進を抑制する作用がある。さらに、アポトーシスのイニシエーターとして機能するカスパーゼ 9 の増加を抑制し、アポトーシス抑制因子である Bcl-2 の低下を防ぐ。その他にも、細胞障害性に作用する MAPK スーパーファミリー(MAPK、p38、JNK)によるリン酸化を抑制することなども確認されている。 現在、 H2S による細胞保護効果は、臓器移植にともなう虚血再還流障害の予防にも有効と考えられている。それにともない、除放性の H2S ドナーが開発されるなど治療対象に応じた効果的な投与方法が模索されている 19) 。 網膜に過剰な光が照射すると、酸化ストレスが惹起されるとともに、大量のカルシウムイオンが細胞内へ流入するために障害が起きる。これに対して、 H2S は光障害から細胞を保護することが新たに判明した 14) 。マウスの眼球に光を長時間照射すると、光受容細胞の層構造が破壊される。しかし、腹腔に NaHS (0.4375 μmol/kg)を前投与すると層構造は維持される。その際、活性酸素による核酸の損傷が顕著に低下しており、TUNEL 陽性細胞は非投与群の約 80% まで低下する。 H2S には網膜細胞内のカルシウムイオン濃度を低下させる作用があるため、この作用も保護的にはたらく要因と考えられる。 6.H2S とエネルギー生産一部の細菌や古細菌が電子伝達系を駆動する際に H2S を電子供与体として利用することは知られているが、哺乳動物でも同様の事例が報告されている 20-21) 。哺乳動物細胞には、細菌のサルファイド:キノンオキシドレダクターゼ(SQR)と類似の酵素 SQRDL が存在しており、この SQRDL が H2S の電子を補酵素 Q に転移することで ATP を生産すると考えられている。興味深いことに、ラット肝臓から単離したミトコンドリアを用いた検討では、 H2S による ATP 生産の増強作用が 3MP でも認められることや、肝癌細胞株の 3MST をノックダウンすると酸素消費量が低下することから、3MST がエネルギー生産に関与するとの見解が示されている 21) 。この報告の 8 ヶ月前には、同じくエネルギー生産に関してストレス環境における H2S のはたらきが報じられている 22) 。マウス腸間膜動脈から単離した平滑筋細胞にカルシウムイオノフォア A23187 を低酸素条件下で作用させると、サイトゾルの CSE がミトコンドリアに移行し、ミトコンドリアの ATP 含量が増加することが示されている。 ATP の増加は CSE 阻害剤で抑制されることから、CSE によって生産された H2S が、ATP 量を維持することで、低酸素ストレスに対する抵抗性を細胞に付与するとしているが、この検討では A23187 による処理が 24 時間と長く、極度のストレスを細胞に与えた特殊な環境を想定したものと思われる。7.H2S の物性H2S は、無色の気体だが腐卵臭がするのでその存在がわかる、といわれる。しかし、国際化学物質簡潔評価文書(CICAD)によれば、H2S 濃度が 140 mg/m3(99 ppm)以上ではヒトの嗅覚が麻痺するとされる。 560 mg/m3(398 ppm)以上では呼吸困難をきたすため、臭いに気づかず死に至る危険性があることを認識しておく必要がある。NO と CO は水に溶けにくく、溶解度(g/100 ml, H2O/20℃)はそれぞれ 0.006 と 0.003 程度である。一方、 H2S の溶解度は 0.5 と比較的高い。 H2S が水に溶解した場合には、HS- と S2- に解離するが、その解離度は pH に依存する。 pH 7.4 では 8 割が HS- に解離し、残りの 2 割は H2S ガスとして残存する。 H2S の特徴は油にも良く溶けることである。ただし、この場合には HS- には解離せず、 H2S ガスとして油中に存在する。 Dilauroylphosphatidylcholine を含むリポソームを用いた検討 23) では、H2S の膜/水分配係数は 2.0 であるが、膜透過性の良好な NO と CO2 の分配係数がそれぞれ 3.6 と 0.95 であることから、細胞膜は H2S にとって物理的な障壁にはならないと考えられている。数理モデルを用いた H2S の拡散シミュレーションでは、細胞内の H2S がわずか 1 秒間で近隣の 200 細胞に拡散することが示されている 23) 。このモデルでは、夾雑タンパク質等の影響は考慮されていないが、H2S の血中半減期が 151 秒と比較的長いことから、拡散時の損失は最大 7% 程度と低く、実際の細胞においても夾雑物による影響は低いとしている。 H2S の構造は水(H2O)と類似している。 H2O は、アクアポリン(AQP)を介して膜を通過するが、 H2S にも同様の機構が存在するのだろうか。少なくとも古細菌 Archaeoglobus 属の AQP を用いた検討では、 H2S が AQP を通過することを示す結果は得られていない 24) 。ただし最近、真正細菌 Clostridium 属から HS- チャネルが同定された 25)。このチャネルは、formate/nitrite transport(FNT)ファミリーに属する輸送体であり、細菌内に蓄積した HS- を速やかに排出すると考えられている。哺乳動物には FNT ホモログは存在しないが、同様の機能をもつチャネルが存在している可能性も否定できない。 8. H2S の検出法H2S は、反応性が比較的高いため、蛍光誘導体化の対象となることが多い。誘導体化により高感度な検出が可能となる反面、前処理やその後の HPLC による分離に多少の時間を要する。一方、誘導体化処理を施さずに H2S を測定する方法もある。ここではガスクロマトグラフィー法と電極法を紹介する。1.ガスクロマトグラフィー法炎光光度検出器(FPD)が開発されたことで高感度な検出法が可能となった。現在、揮発性の硫黄化合物のみならずリンやスズ化合物を検出する際に幅広く利用されている。移動相には不活性ガスが用いられ、試料中の硫黄化合物が水素炎で燃焼される際に発する波長 394 nm の光を検出する。化学発光硫黄検出器(SCD)を搭載したガスクロマトグラフィーでは、ステンレスバーナーを用いて従来よりも高温で硫黄化合物を燃焼することで、FPD よりも 10 倍以上の高感度を実現しており、1 ppm(1.41 mg H2S /m3)以下まで定量性を示す。最近では半導体ガスセンサを検出器に使用することで、ppb レベルからの計測を可能とするシステムも開発されている。このシステムは、小型設計で移動相用のガスボンベを必要としないという特徴をもつ。ガスクロマトグラフィー法では、生体試料における H2S の生産活性や不安定型硫黄を測定できるが、組織や細胞を破砕することが前提となる。しかし一旦破砕してしまうと、内在性の H2S は生体成分に吸収されてしまうため、正確に測定することは難しいのが実状である。 2.電極法ポーラログラフィーの原理を応用した H2S センサーが開発されている 26-27) 。センサーの先端部にはシリコンとポリカーボネートの共重合膜が皮覆されており、H2S が選択的に膜を透過すると、アルカリ性の電解液内で HS- と H+ に解離する。電極液にはフェリシアン化カリウム(K3[Fe(CN)6])が含まれており、HS- によってフェロシアン化カリウム(K4[Fe(CN)6])に還元された後、白金電極近傍で再びフェリシアン化カリウムに酸化される際に生じる電子を電流値として計測する。システインやグルタチオンをはじめ、酸素や窒素酸化物の妨害を受けることがなく、液相のみならず気相中の H2S を測定できる。検出限界は 10 nM であり、 H2S の濃度変化を 30 秒程度で感知するため、高感度かつリアルタイムに近い検出が可能となっている。ただし、 H2S を検出するためには、ガスクロマトグラフィーと同様に組織や細胞を破砕する必要がある。9.蛍光プローブによる H2S の検出法不衛生な口内環境を放置すると、嫌気性菌が繁殖し H2S が生産される。 H2S は口臭の主因であり、これを予防する観点から呼気中の H2S を蛍光検出する方法が開発されている 28) 。蛍光物質 2,2’-Pyridylbenzimidazole は、Hg2+ と錯体を形成することで消光状態を保つ化合物である。しかし H2S が存在すると錯体は解離し、2,2’-Pyridylbenzimidazole 本来の蛍光を発する。この原理を利用して、測定開始から 2 分以内に H2S を検出できるシステムが構築されており、比較的迅速な検査が可能となっている。工場排水中の H2S は水質汚濁の原因ともなる。その対策として H2S 検出用の蛍光プローブが開発されている 29) 。 2,4-dinitrobenzenesulfonyl 基を有する蛍光物質は微弱な蛍光(F0)を発するが、 H2S との反応によって 2,4-dinitrobenzenesulfonyl 基が脱離する結果、強い蛍光(F)を発する。 25% アセトンを含む水溶液では、F/F0 は 5.02 であり比較的良好な検出感度を示すが、有機溶媒を含まない場合では F/F0 が 1.44 と低値であるため、生細胞を対象とした測定に適用することは難しいと思われる。 2011 年に入り、生細胞に適用できる H2S プローブが相次いで開発された。現在も多くのプローブが開発され続けており、より高感度かつ選択的に検出するための改良も進んでいる。これらのプローブは反応機構に応じて 3 つに類別できる。 ⅰ求核反応型H2S による 2 段階の求核置換反応により蛍光を生じるプローブである(図 3a)。このプローブは、求電子性官能基と蛍光色素からなり、通常は photo-induced electron transfer (PET)効果により消光状態を保っている。しかし、 H2S による求核攻撃を受けると、官能基が脱離し消光状態が解除される。求核反応型のプローブは、 H2S の硫黄原子が官能基に取り込まれるタイプと、蛍光団に取り込まれるタイプの 2 通りに分けられる 30) 。後者は、 H2S そのものを検出する点で特徴的である。なお、システインやグルタチオン等の低分子チオール化合物は、求核攻撃を一度しか行うことができない。そのため、官能基とともにチオール化合物は蛍光色素に保持され、消光状態を保ったままとなる(図 3a)。選択性が高い反面、最大蛍光強度を得るまでに 1 時間程度を要するものが多い。 内在性の H2S は比較的速やかに代謝されるため、リアルタイムでのモニタリングには不向きと思われたが、 H2S との反応から 2 分程度で約 30 倍の蛍光を生じるプローブが開発されるなど改良が進んでいる 31) 。ⅱ還元反応型アジド基(-N3)またはニトロ基(-NO2)を H2S の還元力でアミノ基(-NH2)に変換することで蛍光を生じるプローブである(図 3b)。 現時点ではこの反応を利用したプローブが多く、全体の半数以上を占める。求核反応を利用した場合よりも H2S との反応に要する時間が短いものが多い。なかでも Dansyl azide(DNS-Az) 32) は、強力な電子吸引性をもつスルホニル基にアジドを付加した化合物であり、 H2S との反応を加速させることに成功している。秒単位で反応が終了し、選択性も比較的高いため、短時間で代謝される H2S を追跡する上で効果的と思われる。他の多くが化学的に合成した蛍光色素をプローブとして用いるのに対して、遺伝的にコードされる蛍光タンパク質を利用した H2S プローブも開発されている 33) 。人工 tRNA を用いて p-Azidophenylalanine(pAzF)を付加した変異型 GFP(cpGFPTyr66pAzF)は、 H2S で還元されると強力な蛍光を発する。反応は数分で終了し、GFP にシグナルペプチドを付加すれば、特定のオルガネラにおける H2S の動態を解析できると考えられている。 ⅲ金属イオン放出型銅錯体を形成した azamacrocyclic 環または 8-hydroxyquinoline を蛍光色素に付加した化合物である 34-35)。通常は、消光状態を保っているが、 H2S によってCu2+ が放出されると消光が解除される(図 3c)。比較的短時間に反応が終了し、10 分以内に最大蛍光強度を示す。還元反応型のプローブとは異なり DTT による影響を受けにくいのが特徴で、0.1 mM DTT 存在下でも精製 3MST から生産される H2S を検出することができる 34) 。細胞抽出液を調製する際には、酵素の失活を防ぐ目的で還元剤を添加することが多いため、in vitro での解析に有効である。マルチウェルプレートを用いれば、短時間かつ簡便に H2S を検出できるため、多検体解析時に特にその威力を発揮すると思われる。これまでに開発されている H2S プローブの多くは可視光で励起するが、可視光域ではヘモグロビンなどの生体成分の吸収率が高く、透過性が低いために生体深部の観察は不向きである。この点を考慮して、近赤外光(near-infrared, NIR)で蛍光を発するプローブが最近開発された 36-38) 。還元反応型の Cy-N3 は、励起波長 625 nm の NIR で蛍光を発するプローブである。 H2S 非存在下では、Cy-N3 の極大蛍光波長は 710 nm であるが、 H2S 存在下では極大波長が 750 nm に移行する。両波長の比率は H2S の濃度に相関するため、レシオメトリックなプローブとして利用することができる。単波長で検出する場合とは異なり、不均一なプローブ分布に伴う蛍光強度の誤差を補正できる利点がある。その他にも、2 光子励起顕微鏡を用いた H2S の検出が試みられている 39) 。還元反応型のプローブ FS 1 は、励起波長 750 nm の NIR で 2 光子励起すると蛍光を発する。この方法により、海馬スライスの深部領域(90~190 μm)において内在性の H2S を蛍光検出できるとしている。ただし、検出時には 400 ~ 680 nm の広域帯の蛍光をとらえており、H2S 以外の生体成分による可能性も否定できない。特異性に関する更なる検討が必要と思われる。 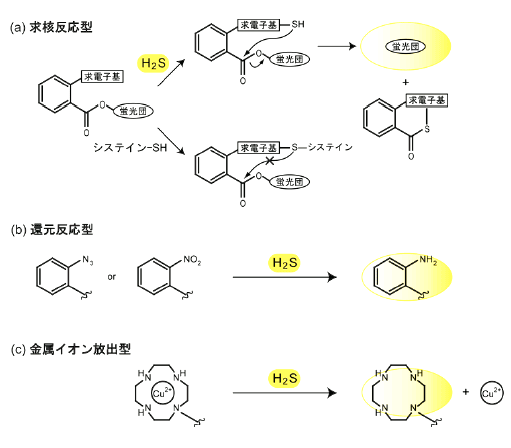 図 3 H2S プローブの反応機構 図 3 H2S プローブの反応機構
(a) 求核反応型 このプローブは求電子性基と蛍光色素をもつ。通常は photo-induced electron transfer(PET)効果により消光しているが、H2S による求核攻撃を受けると、官能基が脱離し消光が解除される。システインなどの低分子チオール化合物は、求核攻撃を一度しか行えないため、蛍光を発することができない。(b)還元反応型 プローブのアジド基(-N3)またはニトロ基(-NO2)を H2S の還元力でアミン基
(-NH2)に変換することで蛍光を生じる。(c)金属イオン放出型 銅錯体を形成した azamacrocyclic 環などを蛍光色素に付加した化合物であり、通常は消光状態を保っているが、H2S によって Cu2+ が放出されると蛍光を発する。 10. おわりにH2S は、上述の通り多彩なはたらきを示すが、NO と共存した場合には、ニトロソチオール(HSNO)を形成することで単独では認められない新たな作用を発揮することもわかりつつある 40) 。現在開発が進展している H2S プローブに加えて、他の生理活性物質との反応生成物や不安定型硫黄等を可視化できるプローブを利用できれば、 H2S 動態の理解は一層深まると思われる。分子間クロストークにも注目が集まりつつあるなか、 H2S 研究の進展に寄与したいと考えている。 |
2014年10月27日月曜日
Hydrogen Sulfide As Bio Effective Molecules 2014
登録:
コメントの投稿 (Atom)


0 件のコメント:
コメントを投稿